さまざまな分子の表記法
今回は分子の表記法について解説します。分子がどのような形をしてどのように結合しているのかを理解するのには、これから説明する表記法を覚えなければいけないので、大雑把なものですが必要なものをまとめました。
目次
分子式
一番よく目にするのではないでしょうか、分子を構成している元素の種類とその数を表したのが分子式です。
水素分子ならH₂
酸素分子ならO₂
アルゴンならAr
塩化ナトリウムならNaCl
このような化学反応式によく用いられます。ちなみに、アルゴンのような1つの原子で構成されている分子を単原子分子、水素分子や酸素分子のような、2つの原子で構成されている分子を二原子分子、水分子のような3つの原子で構成されている分子を三原子分子と言いますが、3つ以上は多原子分子と呼ばれます。
電子式(ルイス構造)、ケクレ構造
電子式(ルイス構造)
元素記号の周りに、その原子の最外殻電子を点(・)を使って表した式を電子式(ルイス構造)と言います。
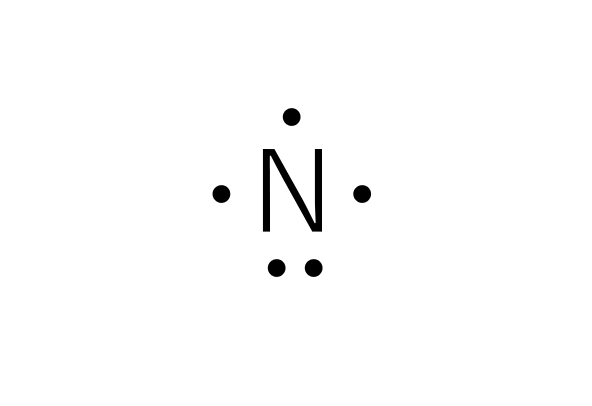
窒素原子の最外殻電子の数は5
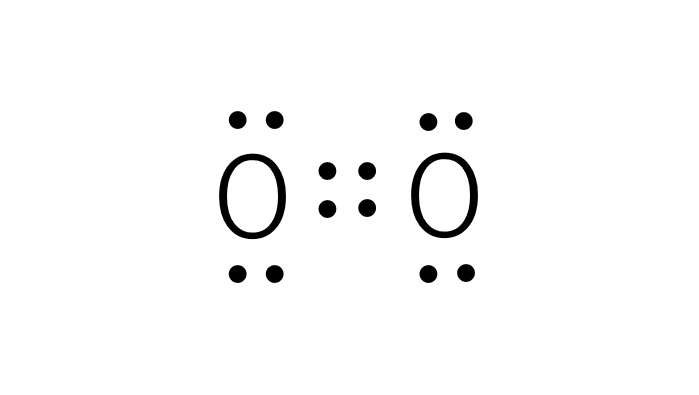
酸素分子(酸素原子の最外殻電子の数は6)
窒素原子の電子式を見てみると、2つの点があるところと1つの点のところがあります。2つの部分をそれらの電子が対になっていることから電子対と呼び、1つの部分を不対電子と呼びます。
酸素分子の電子式を見てみると、2つの元素記号の間にある点とそうではない点があります。元素記号の間にある点は2つで1つの原子間の結合(単結合)を表します。酸素分子は間に4つの電子を持っているので、2つの結合(二重結合)を持っています。窒素分子などの分子は原子間で6つの電子を共有していて三重結合を作ります。結合を作る電子対を共有電子対といい、共有されていない電子対を非共有電子対と言います。
このような結合は、ほとんど不対電子を共有しあってできています。(例外として、オキソ二ウムイオンがある)
このように、原子同士がそれぞれの電子を出し合って共有してできる結合を共有結合と言います。
ケクレ構造
電子式の中で、結合を表す点を線(ー)に置き換えたものをケクレ構造と言います。
塩化水素
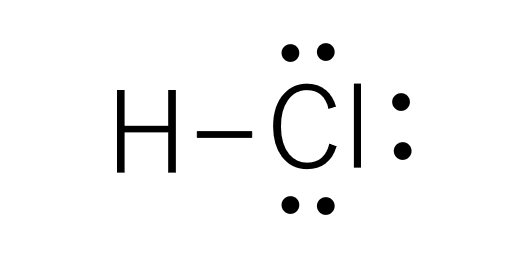
酸素分子

これはただ結合部分が線として表しているだけなので、むしろ電子式よりわかりやすくなりましたね。
構造式
結合部分を線(ー)で表した式を構造式と言います。ケクレ構造から非共有電子対を表す点を除いたものと考えて大丈夫です。
エタノール(C₂H₆O)
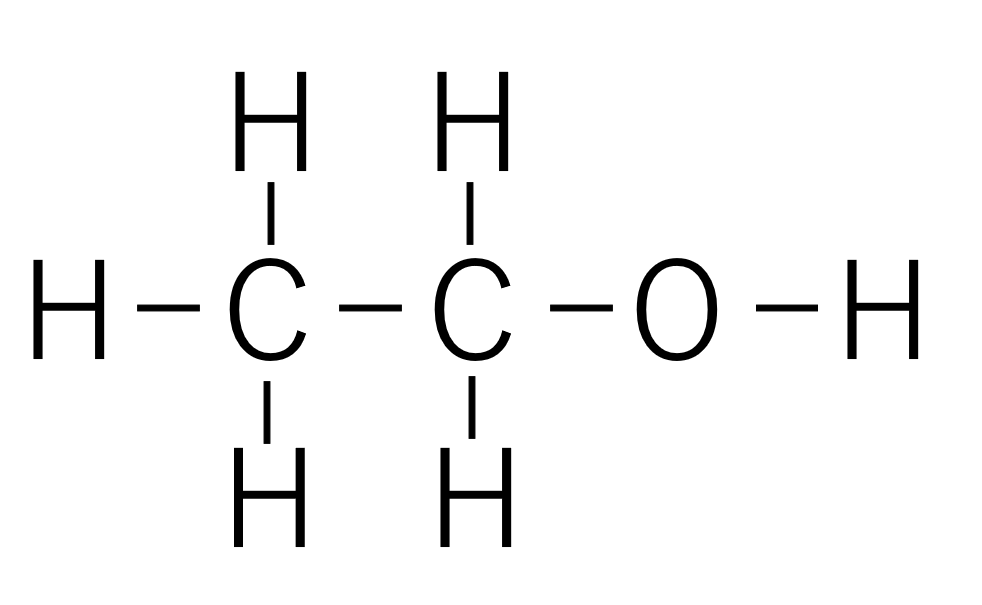
酸素分子
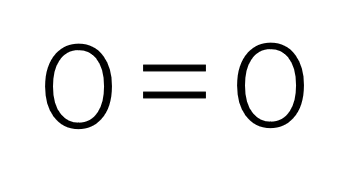
有機化合物ではしばしば構造式が簡略化され、原子のつながり方がわかる程度にーHの結合を表す線が省略されます。
簡略化されたエタノール
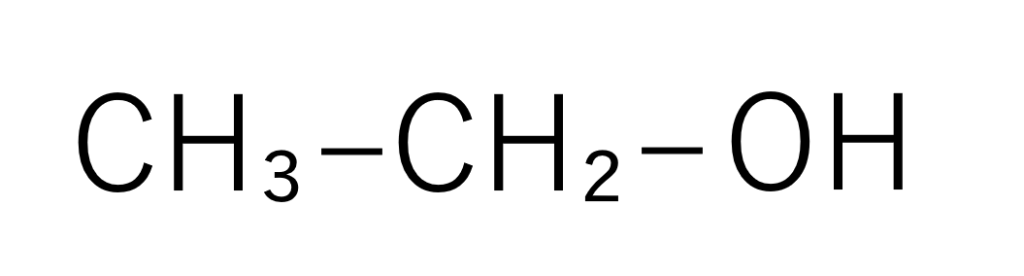
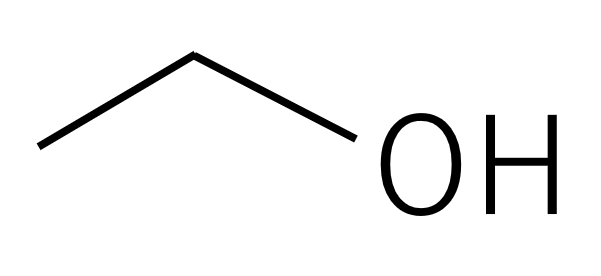
骨格構造
骨格構造は有機分子に使われ、基本的に炭素原子は書かず(強調したいときは書くこともある)、線と線の交点、線の端を炭素とみなします。炭素水素結合は普通は省略され、炭素の価電子は4つあるので、それを満たすように水素原子を頭の中で補い、炭素水素以外の原子は書かなければなりません。
エタノール
アドレナリン
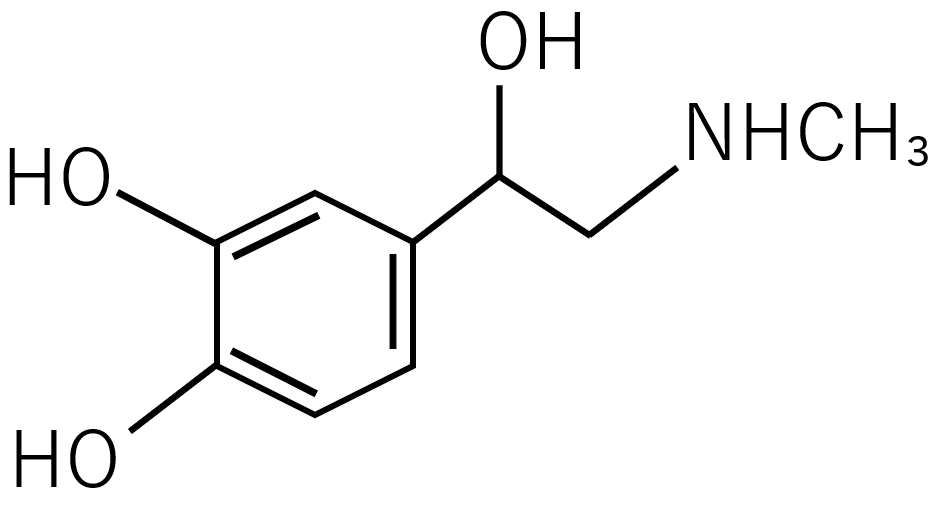
骨格構造では原子同士の結合を明確にするために、アドレナリンのようにHーOの結合であることをはっきりさせるためHOーと書くことがあります。このような結合の表し方は他にも、H₃Cー、H₂Nーのようなものがあり、これは簡略化された構造式でも同じようなことが言えます。とはいえ、これは骨格構造を書く上で必須なものではないので好みの部分であることに注意してください。