[高校化学]アルカリ金属
目次
アルカリ金属の性質
アルカリ金属って何?
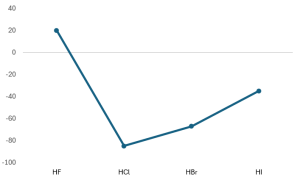
アルカリ金属は周期表の、H(水素)を除く1族元素でLi,Na,K,Rb,Cs,Frの元素を示します。
主な性質は以下の通りです。
- アルカリ金属の原子は1個の価電子を持つため、1価の陽イオンになりやすい。
- イオン化傾向が大きい。
- 密度は小さく、融点も低い。
- 銀白色で軟らかい。
- 空気中で酸化されやすい。そのため、石油中に保存する。
- 還元力が強く、水と激しく反応して水素と強い塩基性を持つ水酸化物を生成する。
単体ナトリウムで水切りをする動画ってありますよね、あれはナトリウムの強力な還元力によって水中で爆発的な反応を起こし、何度も水面から飛び出てくることでナトリウムで水切りを行っているわけなんです。
| Li(リチウム) | Na(ナトリウム) | K(カリウム) | Rb(ルビジウム) | Cs(セシウム) | |
| 密度(g/cm³) | 0.53 | 0.97 | 0.86 | 1.53 | 1.87 |
| 融点(℃) | 181 | 98 | 64 | 39 | 28 |
| 炎色反応 | 赤 | 黄 | 赤紫 | 赤 | 青 |
ナトリウムの化合物
NaCl(塩化ナトリウム)
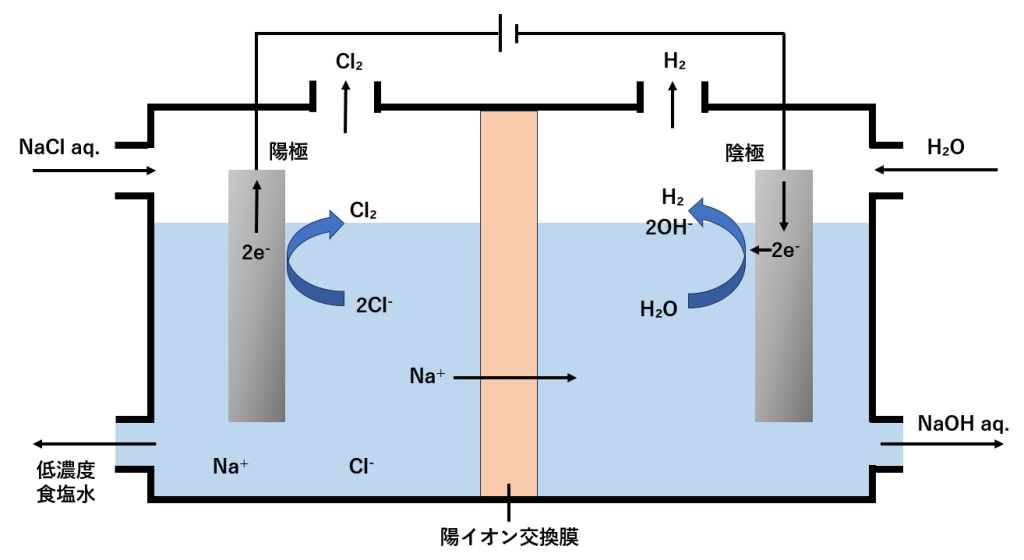
NaClを電気分解することで単体のナトリウムを得ることができます。だだし、ここで注意しなければならないのは、アルカリ金属はイオン化傾向が大きい性質があるため、水溶液を電気分解しても単体は得られないので、化合物を高温で融解して電気分解することで単体のナトリウムを得ることができます。このように、化合物を融解させて電気分解を行うことを溶融塩電解といいます。
塩化ナトリウムの水溶液を電気分解した場合、陽極からは塩素が、陰極からは水素が発生するため、水溶液中にはナトリウムイオンと水酸化物イオンが残り、水酸化ナトリウム水溶液を得ることができます。
NaOH(水酸化ナトリウム)
水酸化ナトリウムの性質を簡単にまとめてみます。
- 水に溶かすと発熱し、水溶液は強塩基性を示す。
- 空気中に放置しておくと、空気中の水分を吸収して溶ける潮解という性質を持つ。
- 空気中の二酸化炭素を吸収し、炭酸ナトリウムを生成する。
水酸化ナトリウムは工業的に多量に使用されていますが、劇物に指定されているため、取り扱う際には十分に気をつけてください。
Na2CO3(炭酸ナトリウム)
続けて、炭酸ナトリウムの解説に移りたいと思います。炭酸ナトリウムはアンモニアソーダ法(ソルベー法)を用いて工業的に作られます。アンモニアソーダ法の主な反応は2つあり、塩化ナトリウムに水、アンモニア及び二酸化炭素を加えることで炭酸水素ナトリウムを生成し、それを熱分解させることによって炭酸ナトリウムを生成します。
炭酸ナトリウムの性質を簡単にまとめてみます。
- 白色固体で、水に可溶である。
- 強酸を加えると分解し、二酸化炭素を発生させる。(ただし、加熱しても分解しない。)
- 再結晶させると、無色透明な炭酸ナトリウム十水和物の結晶(Na₂CO3・10H2O)が得られる。
- 炭酸ナトリウム十水和物を空気中で放置すると風解という現象が発生し、水和物の一部を失って、白色の粉末状の炭酸ナトリウム一水和物(Na2CO3・H2O)が得られる。
NaHCO3(炭酸水素ナトリウム)
別名重曹とも呼ばれ、胃薬や消火剤など多種多様に使われています。水酸化ナトリウムに二酸化炭素を反応させて生成することができますが、工業的には飽和食塩水にアンモニアを溶かした後に、二酸化炭素を通じるソルベー法の一部で製造されています。
例のごとく、炭酸水素ナトリウムの性質を簡単にまとめてみます。
- 白色の粉末で、水に少しだけ可溶。
- 加水分解によって弱い塩基性を示す。
- 強酸を加える、もしくは熱を加えると二酸化炭素を発生させる。