[高校化学]ハロゲン化物について簡単に解説
目次
それぞれの単体について
まずはそれぞれの単体の性質についてまとめていきたいと思います。
| フッ素(F2) | 塩素(Cl2) | 臭素(Br2) | ヨウ素(I2) | |
| 状態 | 気体 | 気体 | 液体 | 固体 |
| 色 | 淡黄色 | 黄緑色 | 赤褐色 | 黒紫色 |
| 物質量(g/mol) | 38.00 | 70.90 | 159.8 | 253.8 |
| その他の性質 | ハロゲンの中で最も酸化力が強い | 刺激臭を持つ有毒な気体 | 有毒な蒸気が発生 水に少し溶け、有機溶媒によく溶ける | 昇華性 水にほとんど溶けず、有機溶媒によく溶ける |
ハロゲンの物質量の大きさはF2<Cl2<Br2<I2となっているので、ファンデルワールス力の大きさもF2<Cl2<Br2<I2となります。これにより、融点や沸点の大きさもF2<Cl2<Br2<I2の順番に大きくなります。
逆に、酸化力はF2>Cl2>Br2>I2とF2が一番大きくなっています。酸化力は電子を奪う力なので、電気陰性度の関係と同じように覚えれば大丈夫です。
酸化力の差を用いて、以下のような反応式で酸化力の強いハロゲン単体から酸化力の弱いハロゲン単体を生成させることができます。
ハロゲンと水素の関係
酸化力の強いF2は水から電子を奪うことで、以下のような反応式でHF(フッ化水素)を生成します。
また水素単体とも反応し、冷暗所でも爆発的に反応してHFを生成します。
Cl2はF2よりも酸化力が小さいので、一部が水を反応しHCl(塩酸)とHClO(次亜塩素酸)が生成します。
Cl2と水素単体との反応は光を当てながら反応させることでHClを発生させます。
Br₂少し溶けて臭素水になりますが、水素との反応はほとんど起こりません。また、I₂では水にほとんど溶けず、反応も起こしません。
ハロゲン化水素の性質
ここからはハロゲン化水素である、HF,HCl,HBr,HIの性質について説明していきたいと思います。
ハロゲン化水素の酸性度
4つのハロゲン化水素には酸性度に違いがあり、HF<HCl<HBr<HIの順で酸性度が大きくなっていきます。
ここで注意しなければいけないのは、HFとHClの間で酸性度に大きな差があり、HFは弱酸でHCl,HBr,HIは強酸であるという点です。
ハロゲン化水素の沸点
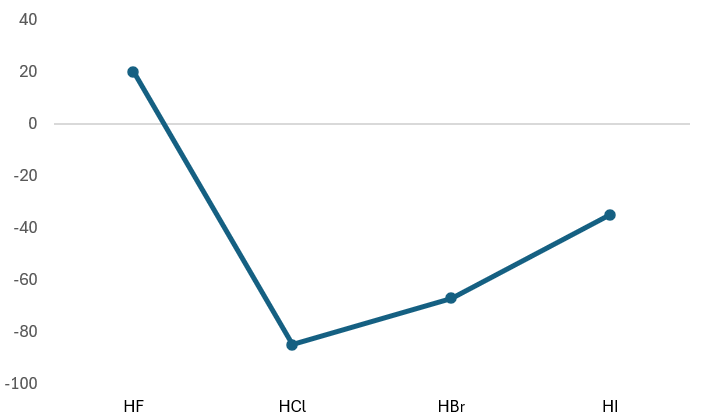
ハロゲン化水素のそれぞれの沸点は、HF(20℃),HCl(-85℃),HBr(-67℃),HI(-35℃)と、HFは分子量が大きいと融点・沸点が高くなるといった法則から外れています。
その理由としては電気陰性度が関係していて、HとFの間には電気陰性度に大きな差があり、その時に分子間にできる水素結合がを強く引きつけ合うため、沸点が高くなるわけです。