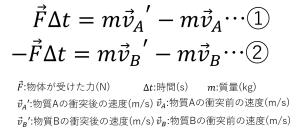基本的な電気分解について
目次
電気分解は電子を使った化学反応?
電気分解は下の図のように、陰極と陽極の二つの電極に電流を流すことで引き起こされ、電極それぞれに化学反応が起こっています。陰極では電子を受け取る反応(還元)、陽極では電子を放出する反応(酸化)が起こっています。
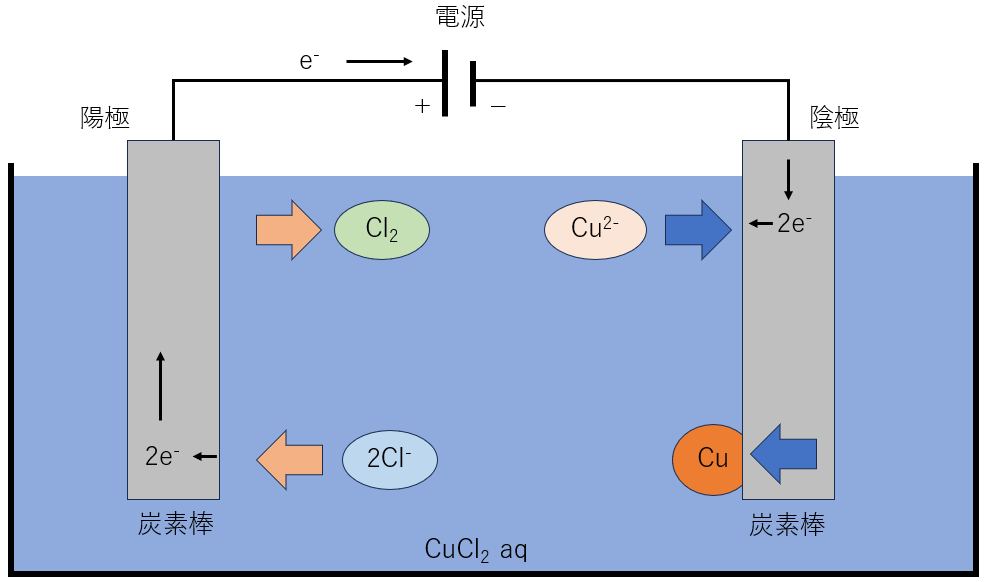
塩化銅(Ⅱ)CuCl₂を電気分解したときの式を見ていきましょう。
(陰極)
(陽極)
このように電気分解では、溶液中に存在する陰イオンから電子を受け取ったり、陽イオンに電子を与えることでイオンではない生成物を与えることができます。
この二つの半反応式を足すと、この電気分解で行われた全体の反応式が以下のように導き出されます。
水の電気分解と酸塩基の関係
水の電気分解をする際に、水の電気伝導性を高めるために酸や塩基を加えます。このとき、加えた溶質が酸か塩基によって電極の半反応式が変わってきます。結局のところ全体の反応式は変わらないんですけどね(笑)
ということで、酸と塩基でどのような違いがあるのか説明していきたいと思います。
酸を加えた場合
(陰極)
(陽極)
塩基を加えた場合
(陰極)
(陽極)
全体の反応式
このように、酸と塩基で違いが出てしまうのは溶液中に存在するイオンの違いによるものです。酸の場合、溶液中には水素イオン(H+)が多量に存在し、塩基の場合では水酸化物イオン(OH-)が多量に存在していて、それぞれのイオンが酸化もしくは還元されるように反応するためこのような半反応式ができます。
溶液中のイオンの反応性
水に塩酸を加えた場合、上の酸による水の電気分解とは違う反応を示します。
塩酸の電気分解
(陰極)
(陽極)
水の電気分解とは違い、陽極での半反応式が変わっていますね。これは、H₂Oよりも塩化物イオン(Cl-)のほうが酸化されやすいため、陽極での酸化反応では優先的に塩化物イオンが反応し、塩素を生成します。
陰極で反応する物質は、溶液中に存在する分子やイオンの中で最も電子を受け取りやすいものであり、
陽極で反応する物質は、溶液中に存在する分子やイオンの中で最も電子を放出しやすいものであることが分かります。
酸性状態で水の電気分解を行いたい場合は硫酸など、発生する陰イオンが酸化されにくいものを選ぶといいですね。
イオン化傾向について
どの陽イオンが陰極で反応するのかは、イオン化傾向を見ればすぐにわかります。
Li>K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>H₂>Cu>Hg>Ag>Pt>Au
イオン化傾向の大きい順に左から順に並べました。
イオン化傾向が大きければ大きいほど陽イオンになりやすく、言い方を変えれば陰極側で反応しずらいということです。具体的な例でいうと、溶液中にNa+とCu2+が同時に存在した場合、Cu2+が優先的に還元されることになります。