イオンについて解説!電離、組成式など
この記事の内容がわからなかったら下の記事から読むのがおすすめです。
目次
イオンとは?
原子は電子と陽子の数が等しいため電気的に中性を示しますが、水への溶解などによって電子がほかの原子から奪われたり奪ったりすることでイオンに変化します。
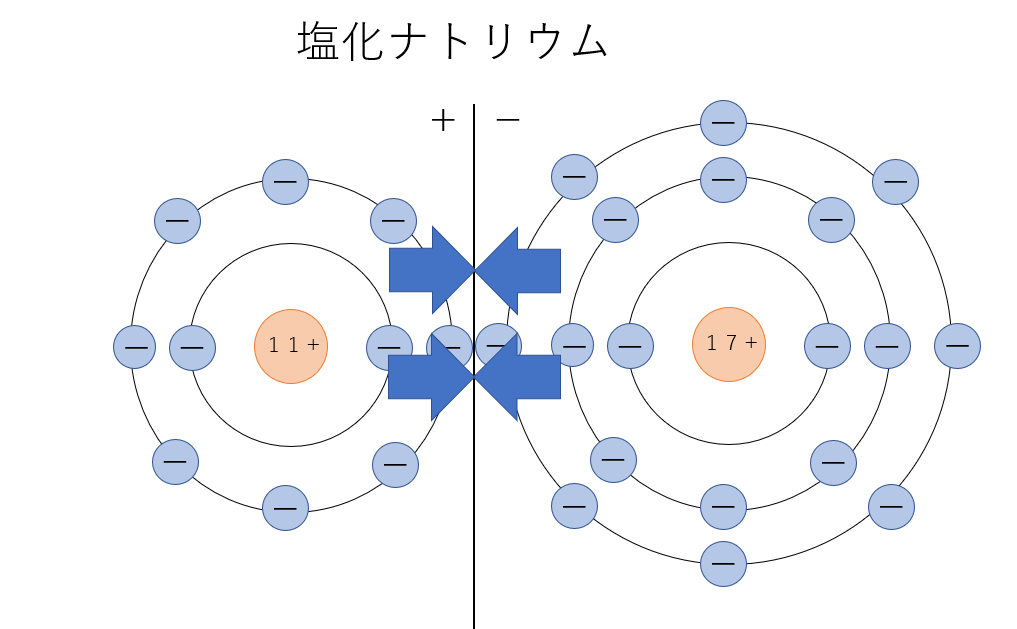
例えば、食塩(塩化ナトリウム)を水に溶かすと以下のように変化します。
ナトリウム原子は塩素原子から電子を奪われ、正の電荷を持つナトリウムイオンに変化し、塩素原子は負の電荷を持つ塩化物イオンに変化します。このように、正の電荷を持つイオンを陽イオン、負の電荷を持つイオンを陰イオンといいます。また、原子が陽イオンになりやすい性質を陽性、陰イオンになりやすい性質を陰性といいます。化合物が水溶液中でイオンに分かれることを電離といい、電離する物質を電解質、しない物質を非電解質といいます。
周期表では左下に行くほど陽性であり、右上に行くほど陰性の性質を示します。
イオン生成の流れ
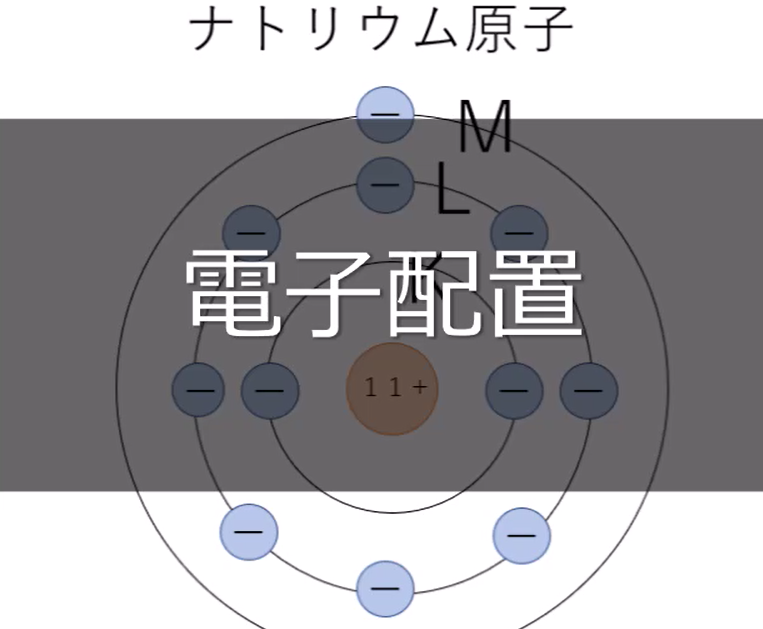
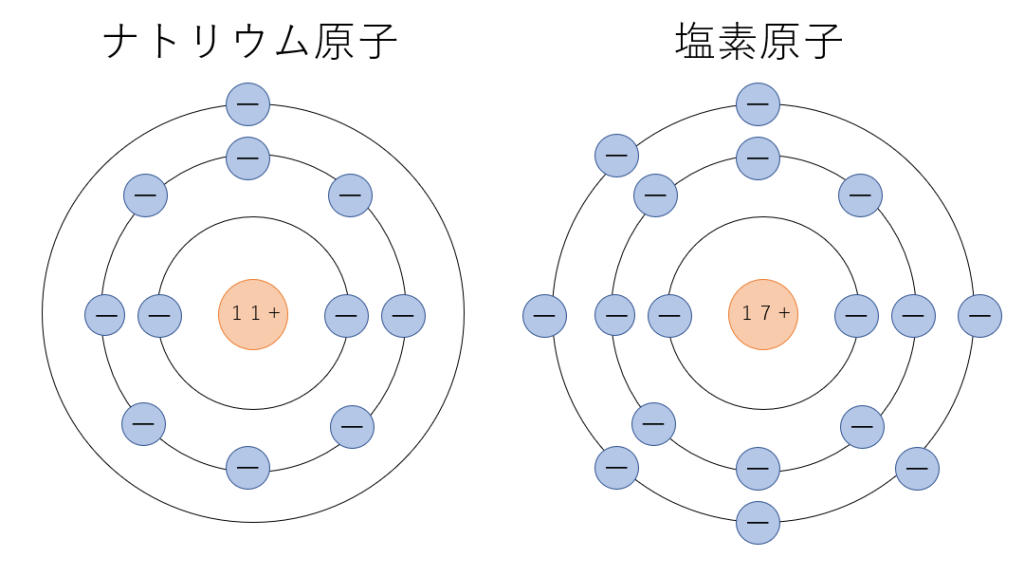
ナトリウム原子と塩素原子の電子の配置はこのようになっています。
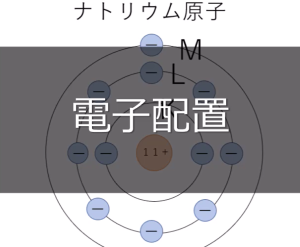
この物質が水の中で溶解しイオンになると、下のようにそれぞれの電子配置が変化します。
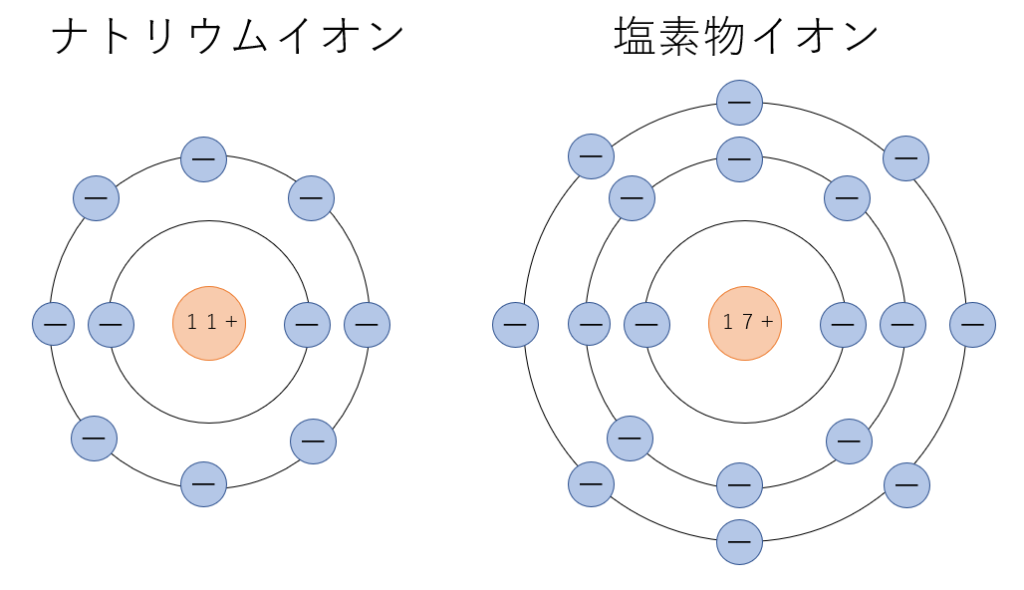
ナトリウム原子の中にある電子一個が塩素原子に移動しましたね。そのため電子の数と陽子の数に差が生じ、電荷を帯びてイオンに変化します。また、このとき移動した電子の数をイオンの価数いいます。
イオン状態の電子配置は希ガスと同じ電子配置を取る傾向があるため、その原子が何族に位置しているかによってその原子がイオンになった時の価数が予測できます。
塩化ナトリウムのようにナトリウムイオンと塩化物イオンが静電的な力(クーロン力)で結び付いている結合をイオン結合といいます。
イオンの大きさ
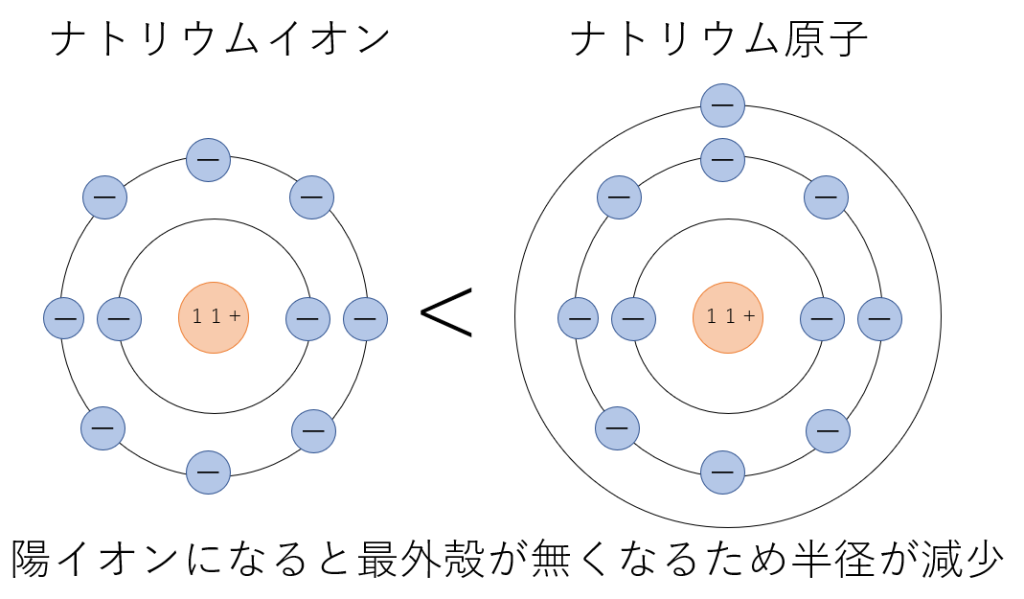
電子の数が変化すると物質の半径も変化します。まずはナトリウム原子とナトリウムイオンの大きさを比べてみましょう。
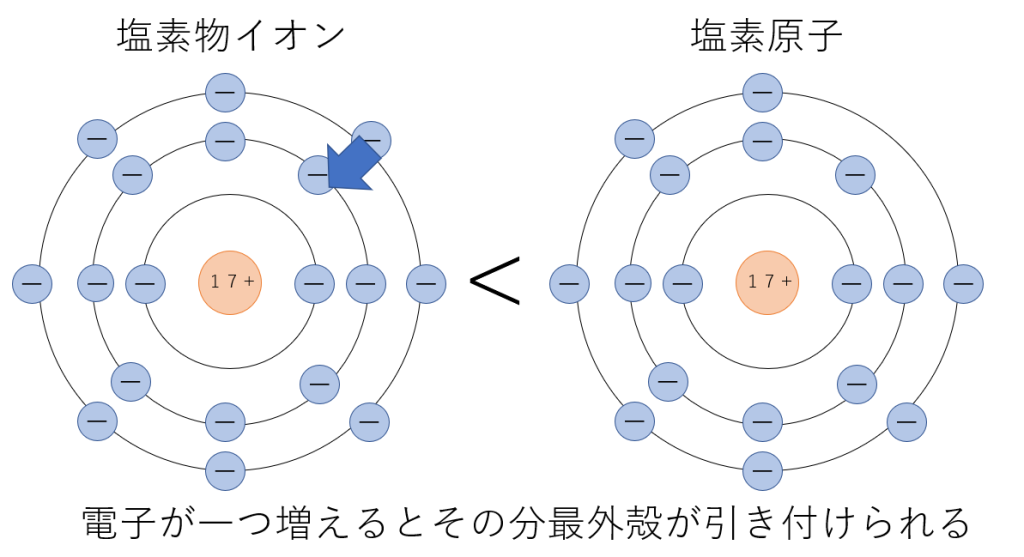
次に、塩素原子と塩化物イオンの大きさを比べてみます。
次に、異なる元素で同じ電子配置のものを比べてみます。
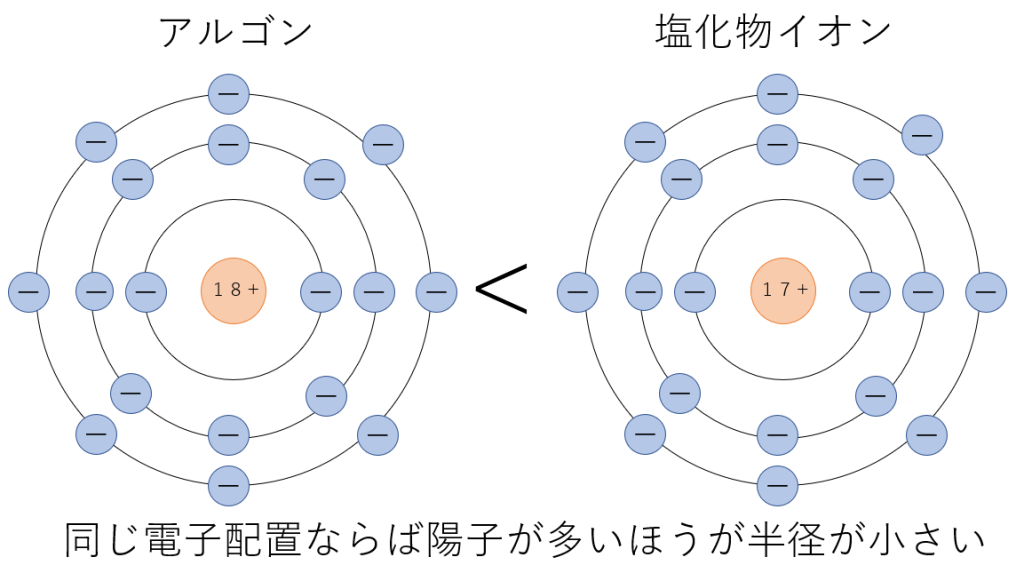
イオン結晶
イオン結合によってできた結晶をイオン結合といいます。
チョークなんかもイオン結晶ですが、落としたら粉々になってしまいますよね。

組成式を書こう
組成式とは、構成されるイオンの種類とその数の割合をもっとも簡単な整数比で表したものです。基本的に、イオンで構成される物質は電気的に中性であるので、中性になるように陽イオンと陰イオンの数を合わせていきましょう。まずは、Mg²⁺(マグネシウムイオン)とCl⁻(塩化物イオン)を例に考えていきます。
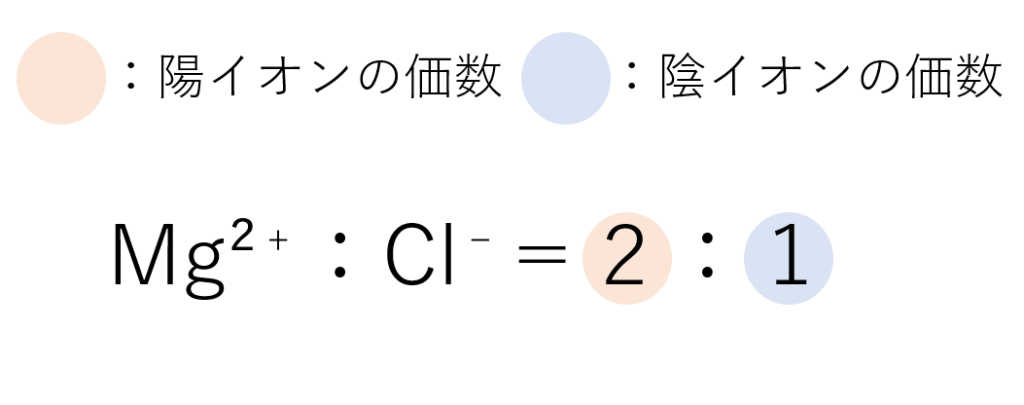

考え方はこんな感じなんですが、簡単に考えれば価数の比を逆にしたものは組成するイオンの個数比になるんですよね。そんな感じで、考え方を学ぶのもそうですが、実践するときに楽にできる方法も覚えておいたほうがいいですね。
関連語句
イオン化エネルギー
原子からひとつ電子を取り去るために必要なエネルギー(吸熱反応)
電子親和力
原子が一つ電子を受け取った時に発するエネルギー(発熱反応)