電子配置です
この記事の内容がわからなかったら下の記事から読むのがおすすめです。
目次
電子の位置関係
電子は原子核の周りに存在しているが、それらは無作為に存在しているわけではなくいくつかの層に分かれて存在していて、その層を電子殻といいます。
電子殻には殻ごとに名前が付けられていて、内側から順にK殻・L殻・M殻・・・と、Kからのアルファベット順で呼ばれています。また、それぞれの殻には決められた数しか電子を収容できず、内側から順に2個・8個・18個・・・というふうに、2n²の数列で増加しています。また、電子は内側にあるほど原子核に強く引き付けられ、エネルギーの低い状態になるので、基本的には内側の電子殻から順に収容されていきます。
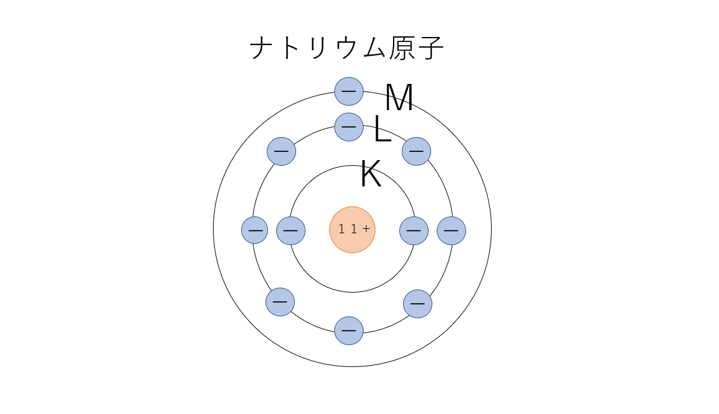
こんな感じで、電子が電子殻へ配列していった形を電子配置といいます。
関連語句
最外殻電子
一番外側の電子殻に存在している電子を最外殻電子といいます。最外殻電子が8を超えることはなく、最外殻電子が8になると一つ外側の電子殻に配列していきます。(そのほうがエネルギーが低くなるから)
価電子
最外殻電子にある、ほかの原子と結合するための役割もしくは、イオン生成の役割に重要な電子を価電子といいます。ヘリウムを除いて、最外殻電子の数が1~7ならば、価電子の数は最外殻電子の数と等しくなります。(希ガスの価電子は0)
閉殻
最大まで電子が収容された電子殻を閉殻(ナトリウム原子ならK殻とL殻)といいます。閉殻になるとその電子殻は安定になるため、最外殻が閉殻になる(HeとNe)とほかの原子と結合しずらくなります。また、最外殻電子が8(He以外の希ガス)になったとしても同じことが言えます。