原子とは?高校で学ぶ原子を振り返る
この記事が初投稿となります。科学の原点と言えばこれかなと個人的に思ったので、今回は原子について解説したいと思います
目次
原子はすべての物質の最小単位!
そんなこと言われてもピンときませんよね・・・簡単に言えば、原子は二つに切って分割できないということです。鉄の塊を何度も細かく切ったとしても最後に残るのは大量の鉄原子の粒というわけです。
原子は何で構成されている?
原子を分割することはできませんが、分解することはできます。原子は電子と原子核に分けられ、原子核は陽子と中性子によって構成されています。また、電子は負の電荷を帯びており、陽子は正の電荷を帯びています。原子は電気的に中性な物質のため、電子の数と陽子の数が等しくなくてはなりません。

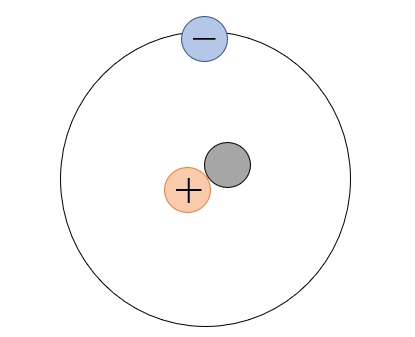
図1の画像でいうと、青が電子でオレンジが陽子、黒が中性子ですね。元素にはそれぞれ番号が振られており、番号が増えていくと同時に陽子の数も増えていきます。つまり…
原子番号=陽子の数
ということになります。なので、図1の画像では陽子が1つあるのでこの原子は水素ということが分かりますね。
陽子の数は原子番号によって変わりますが、電子はそうではありません。ある一定の条件下では、原子は電子を奪われて正の電荷を帯びたり、電子を奪って負の電荷を帯びたりすることでイオンになることができます。イオンについての解説はまた別の機会で話そうかなと思います。
元素はそれぞれ特有の原子量をもつ
まず、原子量(分子の場合は分子量)とは何かと言いますと、ある原子が約6.02×10^23個(約6020垓個)を集めた時の質量です。水素原子の原子量は約1.0、炭素は約12などそれぞれの元素によって決まっています。この時集めた原子の個数はアボガドロ定数と呼ばれ、molという単位の基準となっています。
6.02×10²³(個)=1(mol)
molの概念は化学式を解いたり理解するのに必要なので、必ず覚えておきましょう。
質量数と同位体について
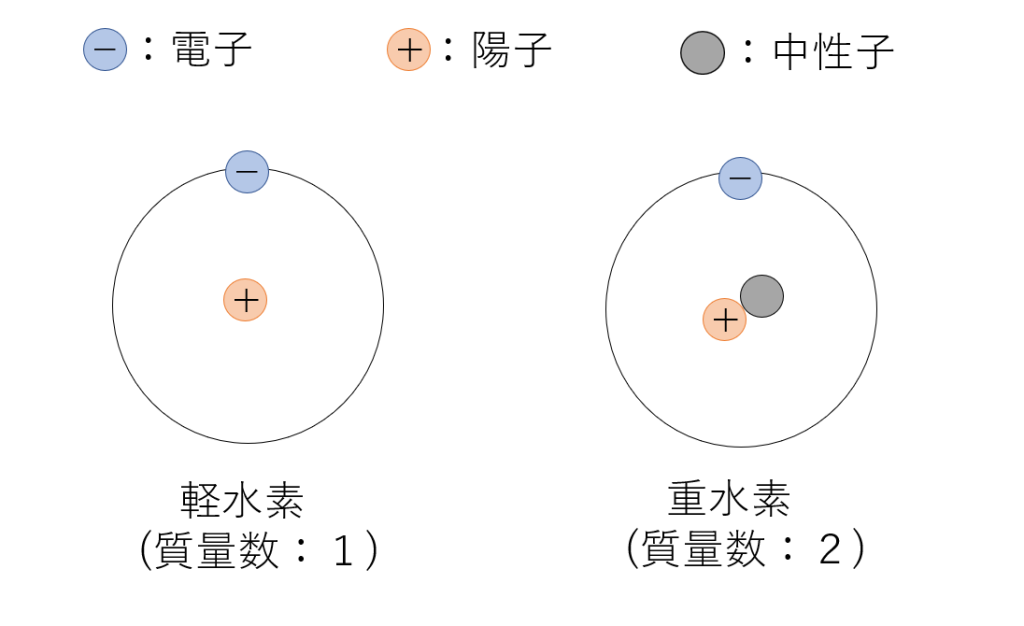
質量数とは原子中の陽子と中性子を足した数のことです。この数は原子量とは違い、元素特有の値を持っているというわけではなく、元素によっては複数の質量数を持つものもあります。水素を例に挙げると、水素のほとんどが質量数1で陽子1つしか持ちませんが(この水素を軽水素といいます。)、ごく稀に、質量数が2で陽子と中性子1つずつもつ重水素というものが存在します。このように同じ元素でも異なる質量数を持つ物体のことを同位体と言います。
電子、陽子、中性子の質量と電荷の比は以下の表のようになっています。
| 粒子 | 質量(g) | 電荷の比 |
| 中性子 | 1.673×10⁻²⁴ | +1 |
| 陽子 | 1.675×10⁻²⁴ | 0 |
| 電子 | 9.109×10⁻²⁸ | -1 |
中性子と陽子の質量はほぼ変わらず、電子の約1840倍の質量を持っています。
そのため、原子全体の質量は質量数にほぼ比例します。
原子の表記法
同じ原子でも質量数が違う同位体があるため、違いが分かるように表記しなければいけません。

また、重水素は単純にDと表したり、質量数3の三重水素はTと表すこともあり、分子の表記法である構造式や骨格構造では、重水素の位置をDにすることで表現したりします。
分子の表記法については以下の記事をご覧ください。