共有結合でつながる分子
この記事の内容が分からなかったら下の記事から読むのがおすすめです。
共有結合とは?
二つの原子がそれぞれの価電子を共有することで、互いが希ガスと同じ電子配置を取ることで安定になり結合することを共有結合といい、非金属元素どうしの結合は基本的にこの結合を取ります。
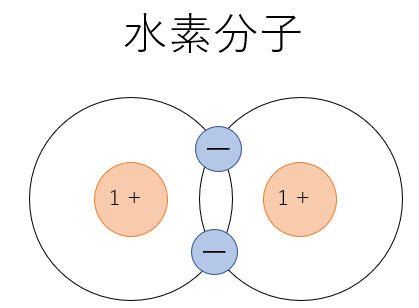
例えば水素分子では互いの価電子を一つずつ共有することでヘリウムと同じ電子配置を取り結合します。
例えば水素分子では互いの価電子を一つずつ共有することでヘリウムと同じ電子配置を取り結合します。
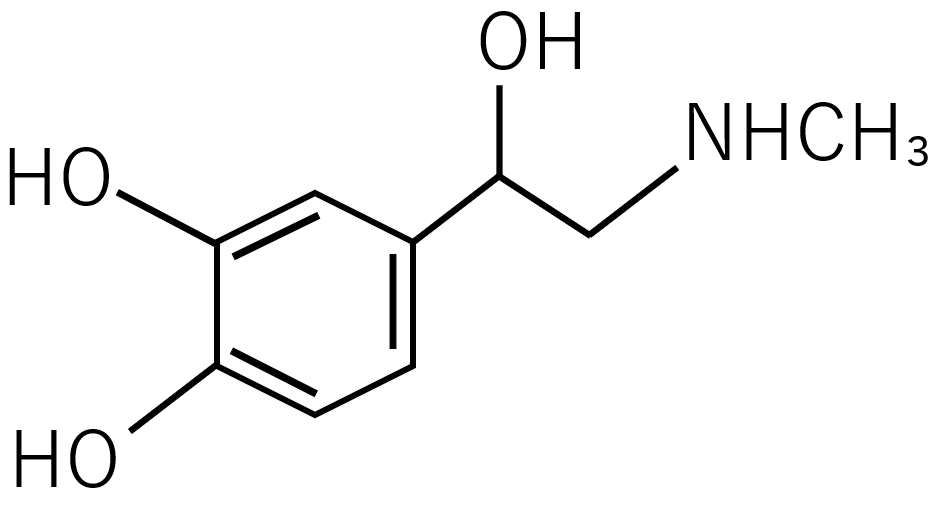
一つの原子に一つだけしか共有結合を持てないというわけではなく、CH₄(メタン)のように炭素原子が四つの水素原子と共有結合しているものもあります。また、水素分子のように各原子から一つずつ電子を出し合うことで結合している単結合と、酸素分子のように各原子から電子を二つずつ出し合うことで結合する二重結合と、窒素分子のように各原子から三つずつ出し合うことで結合する三重結合というものがあります。
電子式と構造式
電子式
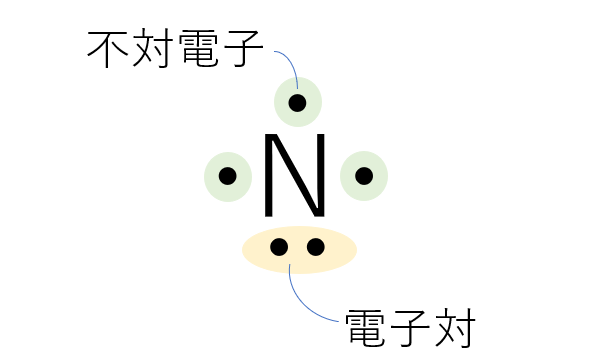
原子単体を電子式で表す場合は、単純にその原子の最外殻電子を点(・)として原子記号の周りに書きます。このとき、電子が二つで対になっているものを電子対といい、対になっていないものを不対電子といいます。
窒素原子

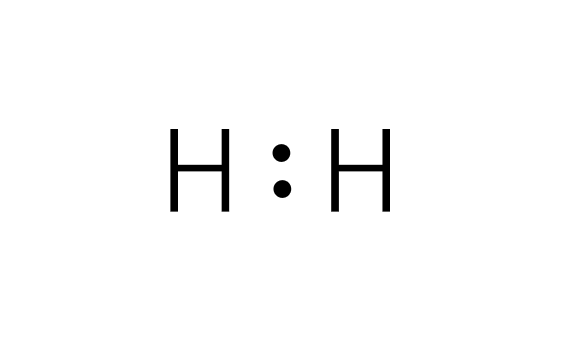
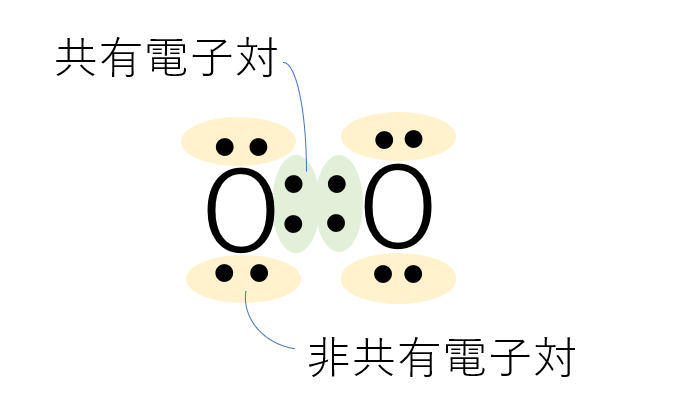
最外殻電子を点(・)で表し、二つの原子記号の間に二つの点を挟むことによって単結合を表します。このとき、原子間で共有されている電子対を共有電子対といい、共有されていないものを非共有電子対といいます。
水素分子(電子式)

酸素分子(電子式)

構造式
構造式では、電子式における一組の共有電子対を一本の線(価数)で表し、非共有電子対は表記していません。
水素分子(構造式)
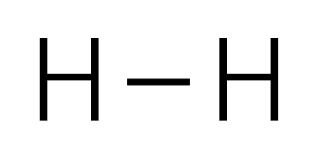
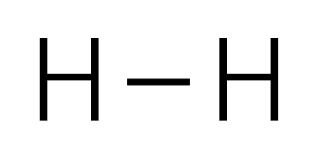
酸素分子(構造式)
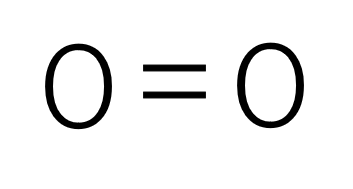
この記事に関連するほかの記事