[高校化学]アルミニウムの性質、製法について解説!
目次
- 単体アルミニウムについて アルミニウムの製法
- アルミニウムの化合物 酸化アルミニウム(Al2O3)
アルミニウムの性質
水酸化物アルミニウム(Al(OH)3)
ミョウバン(AlK(SO4)2・12H2O)
単体アルミニウムについて
アルミニウムの製法
Al(アルミニウム)は13族属する典型金属元素で、原子は3つの価電子を持ち、3価の陽イオンになりやすい。自然界にはO(酸素)、Si(ケイ素)ついで3番目に多く存在しています。しかし、単体として存在しているわけではなく、ボーキサイト(Al2O3・nH2O)を精製して得られる、アルミナと呼ばれる酸化アルミニウム(Al2O3)に、氷晶石(Na3AlF6)を溶融塩電解して製造されます。
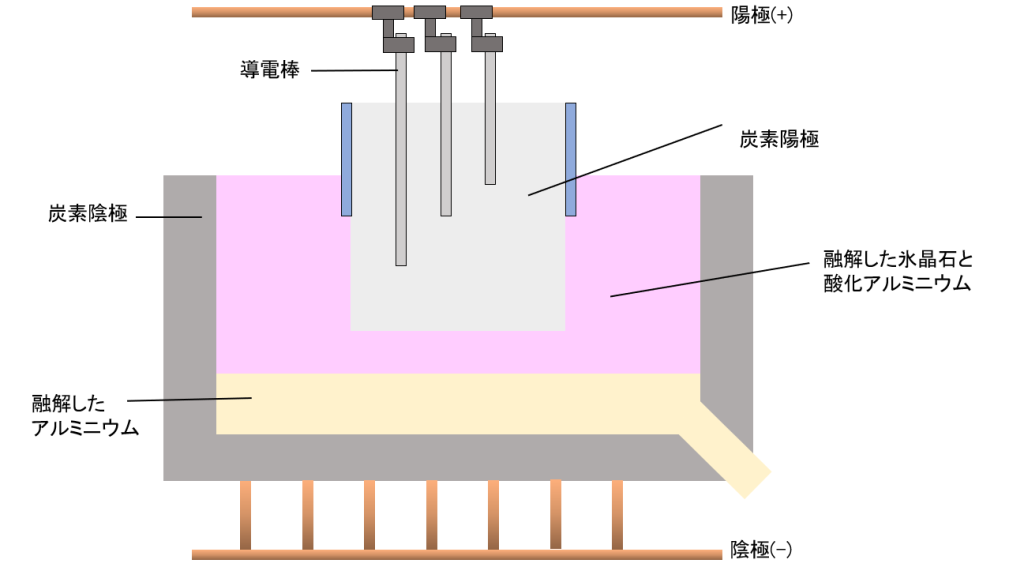
氷晶石は融点を下げる目的でともに溶かし、1000℃で酸化アルミニウムを溶かします。(酸化アルミニウムの融点:2000℃, 氷晶石の融点:1000℃)
以下に、溶融塩電解の陰極と陽極の半反応を示します。
(陰極)
(陽極)
および
アルミニウムの性質
まずは簡単に単体アルミニウムの性質についてまとめてみます。
- 銀白色で延性・展性の性質を持ち、密度2.7g/cm3の軽金属。
- 空気中では、表面にAl2O3の緻密な皮膜を生じ、内部を保護するので、それ以上は酸化されない。また、濃硝酸にも溶けない(不動態)。この性質を利用して、Alの表面に人工的に厚い酸化被膜つけた製品をアルマイトと呼びます。
- 酸素中で高温に熱すると激しく燃焼し、Al2O3になる。
- 常温では水と反応しないが、高温の水蒸気とは反応する。
- Al-Cu-Mgの合金をジュラルミンといい、航空機の機体などに利用される。
テルミット反応
Al粉末とFe2O3の混合物(テルミット)に点火すると、多量の熱を発生して、鉄の酸化物が還元され、融解した鉄の単体を得られます。この反応をテルミット反応と呼び、鉄道のレールの溶接などに利用されます。
両性金属としての性質
アルミニウムは単体、酸化物、水酸化物ともに両性であり、酸や強塩基の水溶液と反応します。
単体
酸化物(両性酸化物)
水酸化物(両性水酸化物)
アルミニウムの化合物
酸化アルミニウム(Al2O3)
アルミナと呼ばれ、白色の粉末で水には溶けません。両性酸化物であり、酸や強塩基の水溶液に反応して溶けます。しかし、酸化アルミニウムを主成分とする結晶である、ルビーやサファイアは極めて硬く、酸や塩基にも溶けません。
水酸化アルミニウム(Al(OH)3)
アルミニウムイオン(Al3+)を含んだ水溶液に、塩基を加えることによってAl(OH)3の白色ゲル状沈殿を生成します。
Al(OH)3は両性水酸化物であるため、酸や強塩基の水溶液のいずれにも溶けるが、アンモニア水には溶けない。
ミョウバン(AlK(SO4)2・12H2O)
硫酸アルミニウム(Al2(SO4)3)と硫酸カリウム(K2SO4)との混合水溶液を濃縮することによってミョウバンと呼ばれる硫酸カリウムアルミニウム十二水和物(AlK(SO4)2・12H2O)の正八面体形の無色透明な結晶が得られる。ミョウバンのように2種類以上の塩が一定の割合で結合した形式で表すことができ、それぞれの成分イオンがそのまま存在する塩を復塩といいます。
ミョウバンが水に溶解すると以下のように電離します。
